Kalzium knackt molekularen Stickstoff
FAU-Chemiker berichten in Science, wie elementarer Stickstoff durch Kalzium (Ca) aktiviert wird
Molekularer Stickstoff (N2) ist ein sehr stabiles Gas mit einer N≡N-Dreifachbindung, die zu den stärksten bekannten chemischen Bindungen gehört. Er wird aufgrund seiner geringen chemischen Reaktionsfreudigkeit unter anderem als Schutzgas für die Lagerung von Lebensmitteln verwendet. Da Stickstoff der Hauptbestandteil der Luft ist, wird er aber auch von Pflanzen als Stickstoffquelle genutzt. Um diesen jedoch aufnehmen zu können, muss das völlig reaktionsträge N2 erst in wasserlösliche Ammonium- oder Nitrit- und Nitrationen umgewandelt werden. Bei Pflanzen geschieht dies durch komplizierte Enzyme, aber der Prozess ist extrem langsam.
Während die Natur Zeit hat, wandelt der Mensch N2 mit dem energieaufwendigen Haber-Bosch-Verfahren in Ammoniak (NH3) um. Die Massenproduktion von NH3 benötigt hohe Temperaturen und Drücke (500 °C, 300 bar). Ursprünglich wurde das Verfahren für die Herstellung von Sprengstoff erfunden, doch heute werden enorme Mengen NH3 als Düngemittel zur Ernährung einer schnell wachsenden Weltbevölkerung benötigt. Dieses industrielle “Brot-aus-Luft”-Verfahren verbraucht bis zu 2 % unseres gesamten Energiebedarfs.
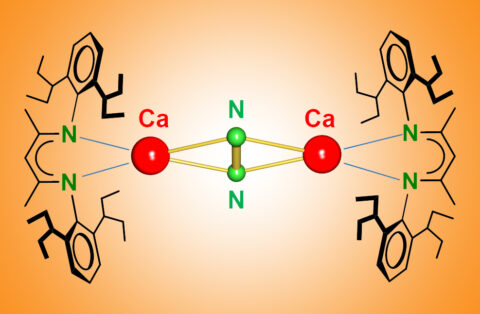
Sowohl natürliche als auch industrielle Prozesse verwenden Übergangsmetallkatalysatoren für die N2-Umwandlung. Die teilweise gefüllten d-Orbitale auf diesen Metallen sind der Schlüssel zur N2-Aktivierung. Nun entdeckten Prof. Dr. Sjoerd Harder, Lehrstuhl für Anorganische und Metallorganische Chemie, und Doktorand Bastian Rösch die N2-Aktivierung mit dem Hauptgruppenmetall Ca bei tiefen Temperaturen.
Bastian Rösch: „Es war eigentlich eine komplette Überraschung für uns. Zusammen mit meinem Kollegen Thomas Gentner haben wir versucht, Komplexe von Ca in der ungewöhnlichen Oxidationsstufe +I herzustellen. Wir fanden heraus, dass diese Komplexe die verwendeten aromatischen Lösungsmittel reduzierten. Zum Beispiel wurde Benzol durch die Aufnahme zweier Elektronen anti-aromatisch. Dann haben wir Alkane als Lösungsmittel verwendet und konnten zeigen, dass niedervalentes Ca(+I) sogar in der Lage ist N2 zu reduzieren, welchen wir ironischerweise als Schutzgas verwendet haben!”
Den vollständigen Artikel haben die Chemiker in Science veröffentlicht: https://science.sciencemag.org/content/371/6534/1125
Sjoerd Harder: „Wir konnten darüber hinaus demonstrieren, dass das aktivierte N2 in Hydrazin (N2H4) umgewandelt werden kann, welches im Gegensatz zu N2 sehr reaktiv ist und als Raketentreibstoff verwendet wird. Dass Ca dieses Kunststück vollbringen kann ist höchst überraschend und wir kamen auf den Gedanken, dass entgegen aller Erwartungen d-Orbitale auf Ca doch eine wichtige Rolle spielen könnten. Umfassende Berechnungen von Theoretikern aus Marburg und Nanjing bestätigten diese Möglichkeit. Obwohl umstritten, wird diese Erkenntis wahrscheinlich die Chemie-Lehrbücher verändern und vielleicht auch die industrielle Forschung anstoßen. Unsere Entdeckung wird Haber-Bosch sicher nicht ersetzen, aber die Tatsache, dass der Haber-Bosch-Katalysator nicht nur Eisen, sondern auch Calciumoxid enthält, regt zum Nachdenken an. Auch das Vorhandensein von Ca in vielen Enzymen oder im Frank-Caro-Prozess, der Reaktion zwischen Ca-Carbid und N2, ist vielleicht kein Zufall. Die Zeit wird zeigen, was Ca noch alles kann. Unsere Gruppe wird ihr Bestes tun, um weitere Geheimnisse des Metalls Ca zu entschlüsseln.“
Kontakt:
Prof. Dr. Sjoerd Harder, PhD
Department Chemie und Pharmazie
Lehrstuhl für Anorganische und Metallorganische Chemie (Prof. Dr. Harder)
- Telefon: +49913185-27350
- E-Mail: sjoerd.harder@fau.de