Magnesium Chemie steht Kopf
Chemiker der Friedrich-Alexander-Universität Erlangen-Nürnberg veröffentlichen jüngsten Durchbruch in der Magnesiumchemie in der renommierten Fachzeitschrift Nature.
Magnesium (Mg) ist ein häufig vorkommendes, frühes Hauptgruppenmetall mit geringer Elektronegativität, das seine beiden Valenzelektronen leicht verliert. In Verbindung mit anderen Elementen kommt es in der Natur nur in seiner stabilsten Form als positiv geladenes Mg2+-Kation vor. Diese Mg2+-Kationen finden sich beispielsweise in verschiedenen Mineralien, aber auch in Chlorophyll, dem Pigment das Pflanzen grün macht. Magnesium in der außergewöhnlichen Oxidationsstufe +I wurde zunächst nur in interstellaren Wolken nachgewiesen, aber kürzlich konnten auch erste Komplexe mit Mg+ isoliert werden.
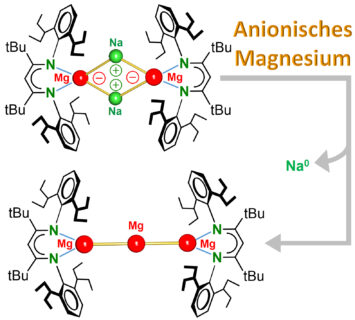
Das Team um Prof. Sjoerd Harder PhD, Lehrstuhl für Anorganische und Metallorganische Chemie, entdeckte nun erste Mg0-Komplexe, in denen das Metall die Oxidationsstufe Null hat und formal sogar negativ geladen ist. Diese Komplexe, die eine einzigartige Magnesium-Natrium-Bindung (Mg-Na) enthalten, reagieren völlig anders als gewöhnliche Mg2+-Verbindungen. Während die elektronenarmen Mg2+-Kationen Elektronen aufnehmen können, reagiert das elektronenreiche anionische Mg0-Zentrum durch Elektronenabgabe.
Der Komplex ist in üblichen organischen Lösungsmitteln löslich und ein extrem starkes Reduktionsmittel: leichtes Erhitzen führte zur sofortigen Reduktion von Na+ zu Na0, einem Metall das normalerweise eine starke Tendenz zur Oxidation zu Na+-Kationen hat. Bei dieser thermischen Zersetzung bildet sich ein neuartiger Komplex, in dem sich drei Mg-Atome wie Perlen zu einer Kette verbinden. Dieser Mg3-Cluster reagiert wie atomares Mg0 und könnte als das kleinste Stück Mg-Metall angesehen werden, ein Stück Metall, das in organischen Lösungsmitteln löslich ist. Diese neue Klasse von anionischen Mg-Komplexen stellt die Mg-Chemie komplett auf den Kopf. Weitere ungewöhnliche Reaktivitäten dieses löslichen, extrem starken Reduktionsmittels sind zu erwarten.
Weitere Informationen:
Den Nature Artikel können Sie hier finden: https://dx.doi.org/10.1038/s41586-021-03401-w
Kontakt:
Prof. Dr. Sjoerd Harder, PhD
Department Chemie und Pharmazie
Lehrstuhl für Anorganische und Metallorganische Chemie (Prof. Dr. Harder)
- Telefon: +49913185-27350
- E-Mail: sjoerd.harder@fau.de