Molekulare Metall-Metall Bindungen, Geisteratome und Elektronen Reservoirs
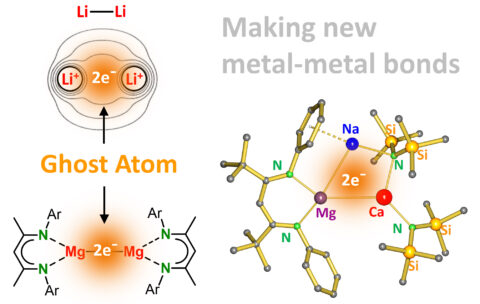
Obwohl die Bindung in Metallen sehr gut erforscht ist, ist das Kreieren von Bindungen zwischen nur zwei Metallatomen eine der zentralen Herausforderungen der modernen metallorganischen Chemie. Molekulare Verbindungen mit Metall-Metall-Bindung verhalten sich ganz anders als Bulkmetalle und finden Anwendung in der Materialchemie oder als bimetallische Katalysatoren, zum Beispiel für die Produktion von Wasserstoff. Eine große Varietät von Bindungen zwischen edlen elektronenreichen Übergangsmetallen wurde bereits umfangreich untersucht. Dagegen gibt es nahezu kaum Beispiele für Bindungen zwischen elektronarmen, elektropositiven s-Block-Metallen. Dilithium, Li-Li, ist das einfachste Beispiel für eine solche Verbindung. In der „Star Trek“-Serie ist Li2 als Brennstoff für das Raumschiff Enterprise unerlässlich. Im Chemiestudium wird Li2 als klassisches Beispiel für die Molekülorbital-Theorie verwendet. In der Realität ist es aber nicht besonderes stabil und zeigt uns, warum Bindungen zwischen elektropositiven Metallen problematisch sind. Beide Li Atome sind nur wenig elektronegativ und sind deshalb bestrebt ihr einziges Valenzelektron abzugeben. So entsteht zwischen den beiden Li+ Kernen ein freies Elektronenpaar. Dieses Maximum in der Elektronendichte wird allgemein beschrieben als ein „Non-Nuclear-Attractor“. Ein Geisteratom: Es gibt Elektronen aber keinen Atomkern! Eine Metall-Metall Bindung mit einem Non-Nuclear-Attractor wurde zum ersten Mal für Magnesium im Jahr 2007 realisiert [1]. Die Mg-Mg-Bindung ist sehr gut von großen Liganden abgeschirmt und das Geisteratom auf der Mg-Mg Achse kann als Elektronenreservoir für die Reduktion von Molekülen fungieren. Seit 15 Jahren gab es viele erfolglose Versuche, schwerere, noch viel elektropositivere s-Block-Metalle aneinander zu binden. Eine aktuelle Publikation in Nature Synthesis aus der Arbeitsgruppe Harder an der FAU beschreibt jetzt eine neuartige Herangehensweise für die Synthese von Molekülen, in denen sogar drei verschiedene Metalle in einer Kette verbunden sind [2]. Diese sehr einfache “mix and match”-Methode könnte Bindungen zwischen einer Vielzahl von Metallen generieren und nutzt die speziellen Eigenschaften eines ungewöhnlichen Komplexes mit einem anionischen Mg-Zentrum aus [3]. Die neuen trimetallischen Moleküle könnte man als molekulare Flaschen für die Speicherung von Elektronen betrachten. Durch Freisetzung der Elektronen können diese Komplexe als extrem starke, lösliche Reduktionsmittel fungieren. Ihre Fähigkeit, sehr stabile Moleküle zu knacken, wurde schon demonstriert. Die Publikation kann bei den Autoren angefordert werden oder ist unter folgendem Link erhältlich.
Link: https://shorturl.at/exV25
Kontakt/Information:
Prof. Dr. Sjoerd Harder, E-mail: sjoerd.harder@fau.de
[1] S. P. Green, C. Jones, A. Stasch, Science 2007, 318, 1754.
[2] J. Mai, J. Maurer, J. Langer, S. Harder, Nat. Synth 2023, https://doi.org/10.1038/s44160-023-00451-y
[3] B. Rösch, T. X. Gentner, J. Eyselein, J. Langer, H. Elsen, S. Harder, Nature 2021, 592, 717.
